
近年来,脂质纳米粒(lipid nanoparticles, LNPs)作为一种新型药物递送系统之一,在制药领域备受关注。尤其自新冠疫情以来,脂质纳米粒作为关键递送载体,被用于制备信使核糖核酸(mRNA)疫苗,对实现mRNA的安全递送及细胞内的快速释放和高效表达起到了举足轻重的作用。
谈到脂质纳米粒,就不得不提脂质体(liposomes)。作为早期脂质纳米粒的一种,“脂质体”一词由Bangham 等人于1965年提出,并由Gregoriadis等人于1970年代将其应用于药物递送。通常脂质体由一个或几个脂质双层组成,其大小在 20 nm至500 nm之间,可包封亲水性药物于脂质体的水性内核,或将疏水性药物装载在脂质双层的烃链区域内。相比于脂质体的而言,“脂质纳米粒” 一词最早出现于1990年代。脂质纳米粒的内核区域呈胶束结构,可根据处方工艺进一步优化用于药物的包封,是一种新型的药物递送系统。脂质纳米粒的通常由四部分组成:(i) 可电离脂质:实现纳米粒的自组装,提高载药包封率,并实现细胞内逃逸;(ii) 稳定剂:用于提高纳米结构的稳定性和细胞膜融合性,常用胆固醇或胆固醇类似物;(iii) 磷脂:用于提高纳米粒脂质结构的稳定性;以及(iv) 聚乙二醇 (PEG)-脂:通过减少与蛋白质的非特异性结合和逃避网状内皮系统(RES)的非特异性吞噬而延长半衰期及体内循环时间(图1)。这些组成成分提高了脂质纳米粒的刚性形态与动力学稳定性,使其不仅能有效递送小分子化学药物,也可用于核酸药物(DNA和RNA)高效递释。
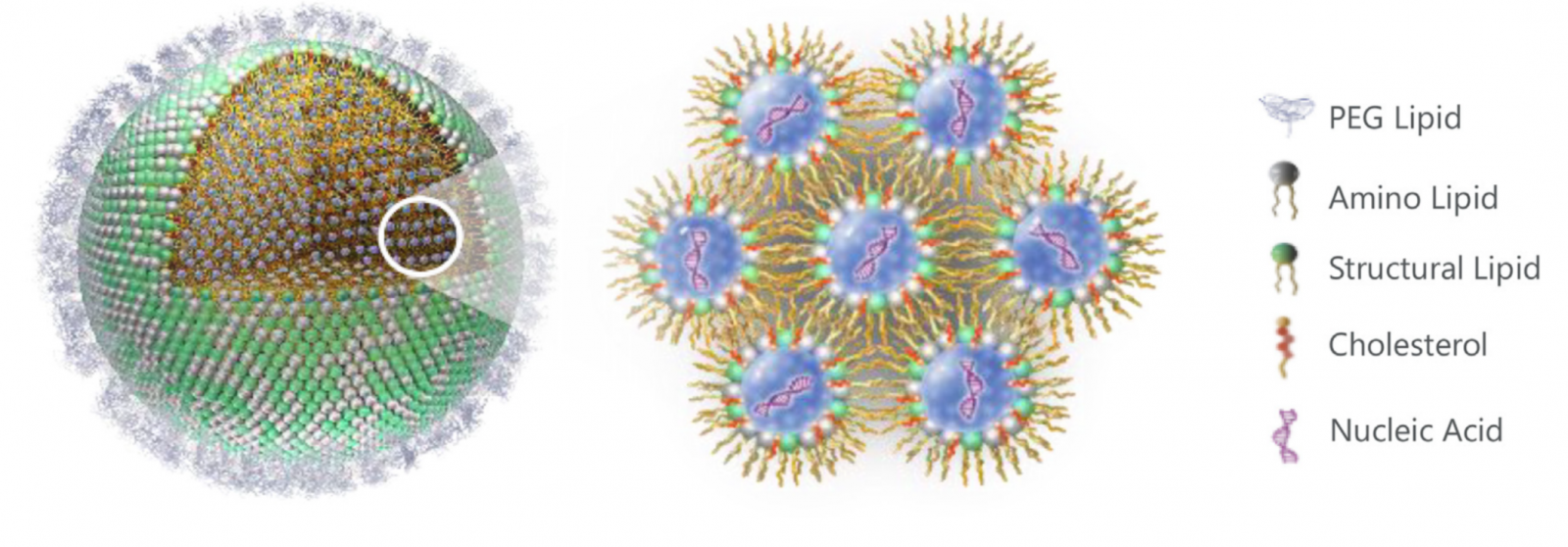
图1. 脂质纳米颗粒 (LNPs) 结构的示意图
其中,可电离脂质作为脂质纳米粒的主要组成成分,是促成核酸药物有效递送的决定性因素之一(图2)。与其他阳离子纳米制剂(如阳离子多聚物、阳离子多肽等)通过传统的电离复合形式与核酸合成复合物不同,可电离脂质可促进核酸药物被纳米粒有效包封于纳米粒内核区域,并形成紧密的纳米结构。当进入人体血液循环系统,脂质纳米粒在生理pH不带明显的正电荷,不易被网状内皮系统清除,改善了药物代谢动力学,提高了半衰期,同时促进了药物在肝脏、肿瘤等靶向组织的积累。而在后期内含体及溶酶体的酸性环境(pH 4.5 – 5.5 ) 中,由于其本身的可电离特性,脂质纳米粒可实现内含体逃逸,从而促进核酸药物的细胞内高效释放(图3)。相比于传统阳离子脂质而言,可电离脂质具有较低的细胞毒性,较高的耐受性,不易在肺部蓄积,及较低的免疫原性等优良特质,极大的提高了核酸药物递送的安全性和有效性。包括海昶生物在内的多个海内外研究机构,已积极开展可电离脂质的优化设计,以进一步推动脂质纳米粒技术的发展。
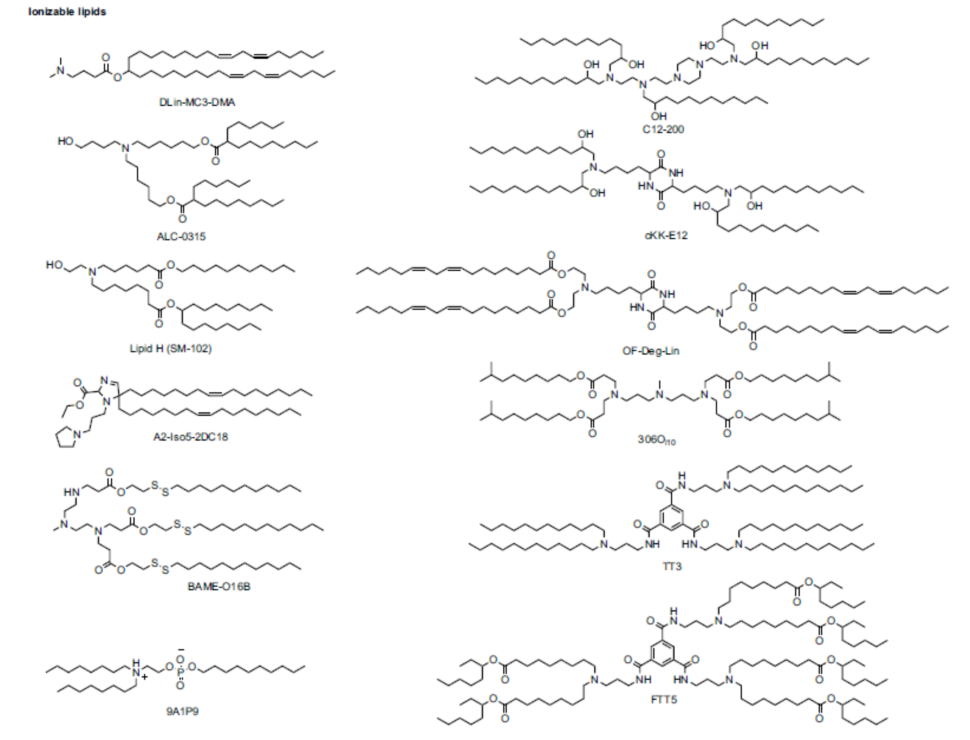
图2. 一些可用于脂质纳米粒制备的新型可电离脂质
海昶生物具备自主知识产权的QTsome即为新型脂质纳米粒的一种。QTsome主要利用四价(Quaternary)– 三价(Tertiary)阳离子脂质制备脂质纳米粒。与其他竞争者的脂质纳米粒技术相比,QTsomes 具有pH值敏感的特性,通过引入在特定条件可电离的阳离子脂质,利用其对外环境pH的敏感性,最大化核酸药物的负载并促进其在细胞内的递送。QTsome同时具有较稳定的脂质外层结构,以保护核酸药物不受降解,并可在细胞内的酸性pH环境中快速释放核酸药物,实现细胞内的高效递送。针对制备过程的优化,QTsome已可实现有效控制纳米粒大小,提高核酸药物包封率,优化体内外转染效率及中试放大生产等。此外,除了进一步优化可电离脂质的设计及组成,海昶生物团队也在紧锣密鼓的开展针对QTsome的多功能修饰优化技术,以进一步克服各种体内生理屏障,实现高效安全的核酸药物递送。
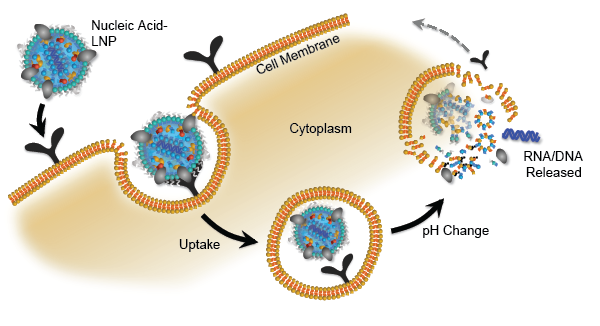
图3. 脂质纳米粒入胞及核酸药物包内释放示意图
参考文献:
1. Rumiana Tenchov, Robert Bird, Allison E. Curtze, and Qiongqiong Zhou. Lipid Nanoparticles—From Liposomes to mRNA Vaccine Delivery, a Landscape of Research Diversity and Advancement. ACS Nano, 2021, DOI: 10.1021/acsnano.1c04996
2. Amit Khuranaa, Prince Allawadhie, Isha Khuranaf, etc. Role of nanotechnology behind the success of mRNA vaccines for COVID-19. Nano Today, 2021, DOI: 10.1016/j.nantod.2021.101142
3. Xucheng Hou, Tal Zaks, Robert Langer, and Yizhou Dong. Lipid nanoparticles for mRNA delivery. Nature Reviews, 2021, DOI: 10.1038/s41578-021-00358-0
4. Precision Nanosystem: https://www.precisionnanosystems.com/platform-technologies/genvoy-platform/genvoy-ilm
5. Eleni Samaridou, James Heyes, Peter Lutwyche. Lipid nanoparticles for nucleic acid delivery: Current perspectives. Advanced Drug Delivery Reviews, 2020, DOI: 10.1016/j.addr.2020.06.002